首页市场资讯
来源:IVD从业者网
10月11日,发表在美国临床化学协会《临床化学》杂志上的一项新研究强化了AACC的建议,即不要使用周期阈值(Ct值)来确定SARS-CoV-2 PCR检测的性能。

今年早些时候,AACC发表了一份公开声明,建议在管理 COVID-19 患者时不要在 PCR 检测中使用 Ct 值。它指出,定量检测的验证更为复杂,需要更严格的测试来确保性能,例如确定量化的下限,而不是检测的下限。

在COVID-19大流行期间,许多RT-PCR检测被FDA授权用于紧急使用,或作为实验室开发的新冠核酸定性检测试剂(LDT)进行验证。然而,美国一些卫生保健提供者和公共卫生机构要求实验室报告数字CT值以及标本检测到新冠核酸时的定量结果。
根据临床和实验室标准研究所(CLSI), CT 值是 "扩增仪器在背景之上可检测所需的周期数"。换句话说,CT 值是放大目标序列的荧光探头信号>用户验证期间确定的最小检测级别的最低 PCR 周期数。较低的 CT 值与测试样本中目标病毒序列(复制号)的较高数量相关。

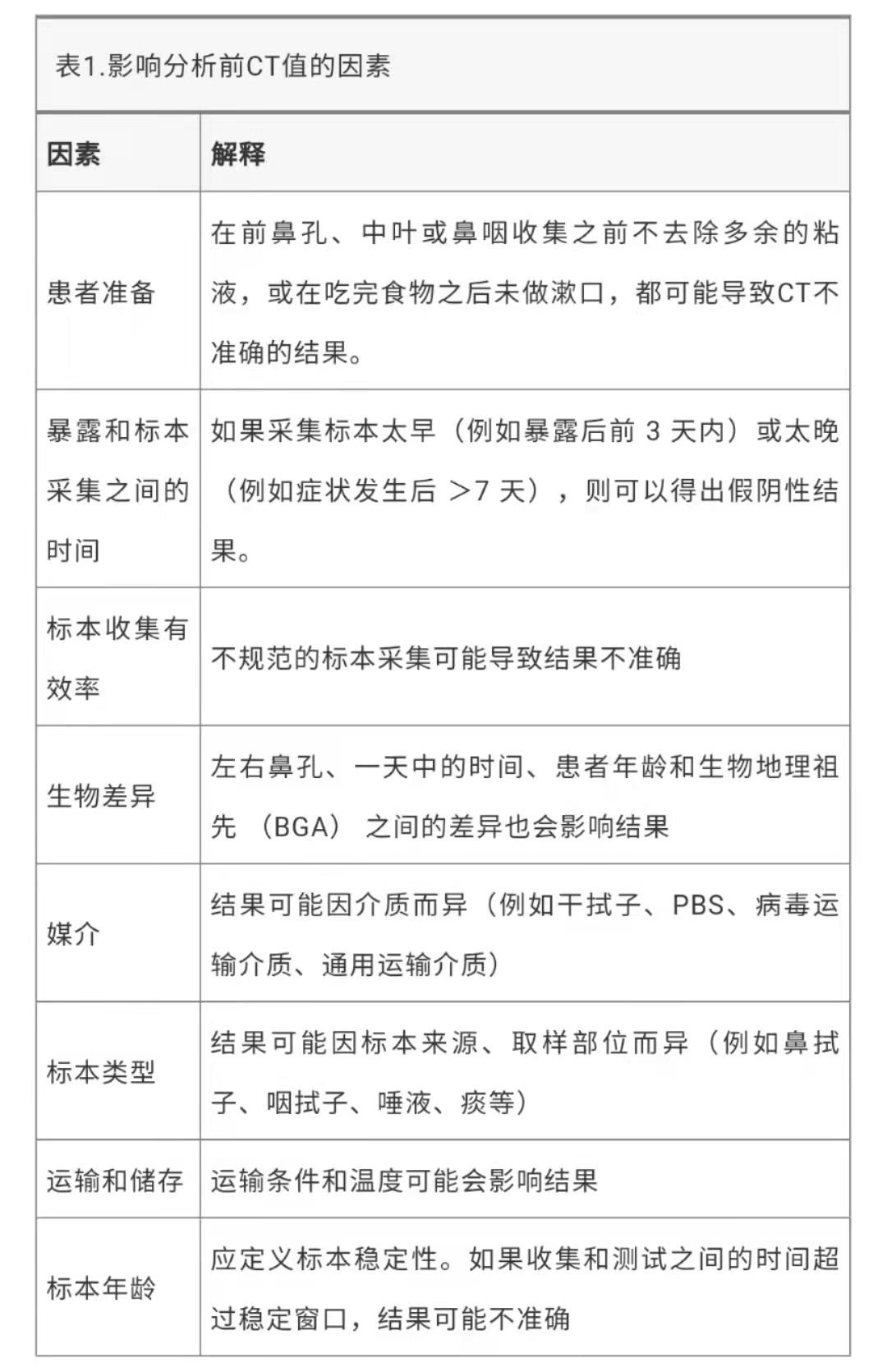
根据统一术语数据库,CLSI 和 ISO 15189 指定了三个检测阶段:分析前、分析中和分析后。影响三个阶段中每个阶段 CT 值的因素如下表。
分析前
导致 CT 值变化的各种分析前环节,包括患者准备、生物差异、标本类型以及运输和储存(表 1)。
分析中
影响实际检测期间 CT 值的因素包括提取效率、荧光探针选择和试剂批次差异(表 2)。

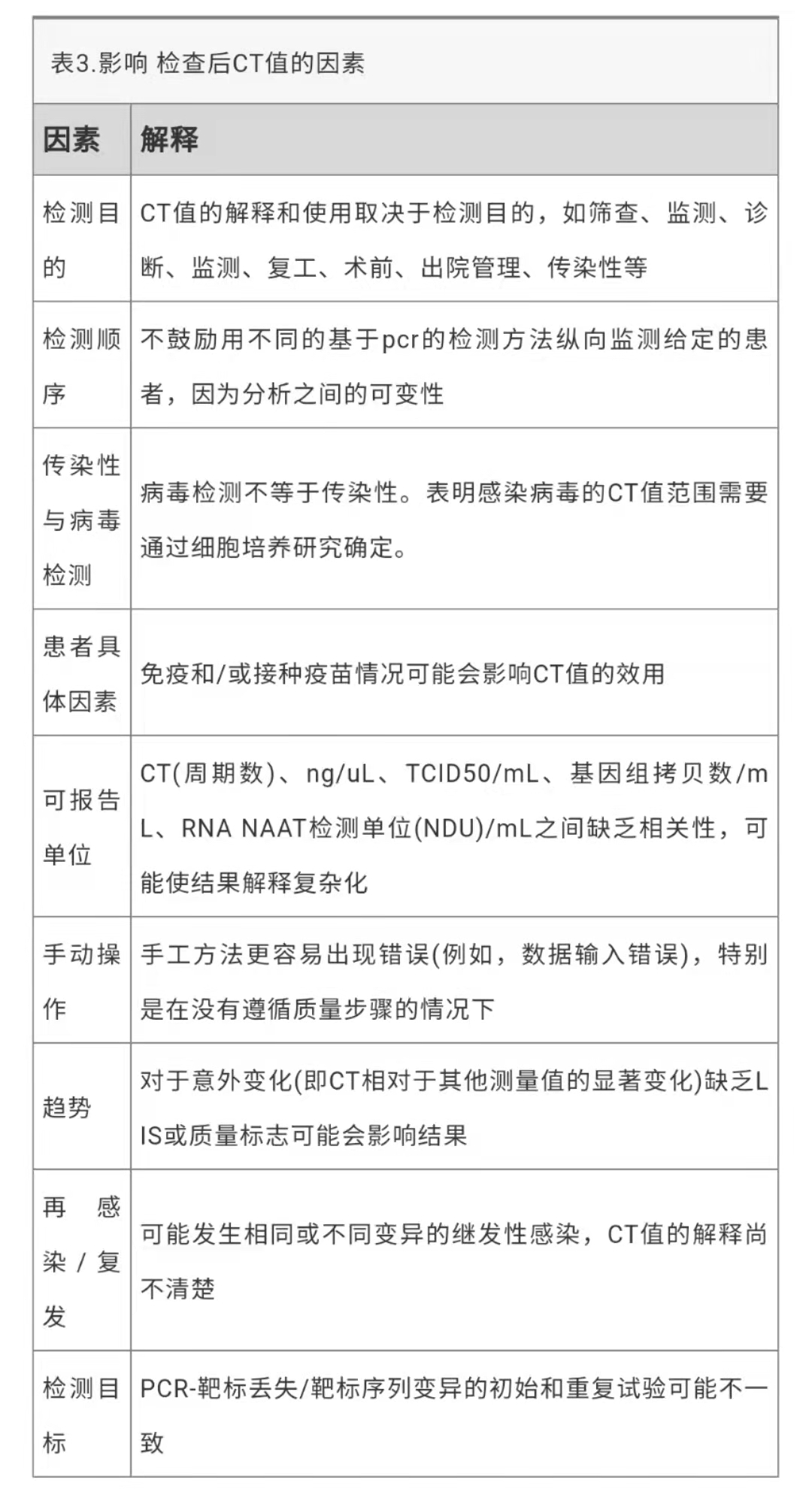
分析后
在分析后的过程中,除检测靶标、可报告单位和检测目标等因素外,CT值还会传递给医疗保健提供者(表3)。
AACC承认实验室在CT值方面处于一个尴尬的位置。正如本文所总结的,报告CT值有许多局限性。虽然实验室意识到这些局限性,但也可能有来自临床同事的压力,要求报告或至少获得CT值。
相关点评:
1.实时荧光PCR是定性方法
2.CT值不具有可比性
-
CLSI: Harmonized Terminology Database. Accessed March 30, 2021. https://htd.clsi.org/listterms.asp?searchdterm=reproducibility&button=Submit
-
Ginzinger DG. Gene quantification using real-time quantitative PCR: An emerging technology hits the mainstream. Exp Hematol. 2002;30(6):503-512. doi:10.1016/S0301-472X(02)00806-8
-
Is there variability in Ct values? doi:10.1093/cid/ciaa1199
-
IDSA and AMP Joint Statement on the Use of SARS-CoV-2 PCR Cycle Threshold (Ct) Values for Clinical Decision-Making.
-
First WHO International Standard for SARS-CoV-2 RNA. Accessed April 22, 2021. https://www.nibsc.org/products/brm_product_catalogue/detail_page.aspx?catid=20/146
-
Binnicker MJ. Challenges and controversies to testing for COVID-19. J Clin Microbiol. 2020;58(11). doi:10.1128/JCM.01695-20

1、凡本网注明“来源:2021广州国际检验医学暨体外诊断试剂博览会”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非2021广州国际检验医学暨体外诊断试剂博览会)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。

