首页市场资讯
来源:生物探索
根据美国FDA官网消息,当地时间2月11日,FDA宣布批准礼来制药新冠中和抗体Bebtelovimab的紧急使用授权(EUA),主要用于治疗成人和12岁及以上儿童患者(至少40斤)的轻度至中度COVID-19患者(图1),以及有高风险发展成为重症COVID-19的群体。
Bebtelovimab可有效治疗新冠
值得一提的是,礼来此次获紧急使用授权的新药可用于治疗新冠病毒变异毒株奥密克戎。

Bebtelovimab EUA授权书截图(图源:FDA官网)
根据对所有可用科学数据的审查,FDA确定有理由相信Bebtelovimab或可有效治疗某些轻度或中度COVID-19患者。此次紧急使用授权的获批主要基于一项临床试验,这项试验评估了单独使用Bebtelovimab以及联合使用Bebtelovimab和其他单克隆抗体治疗轻度至中度COVID-19的疗效。试验结果显示,与安慰剂相比,使用Bebtelovimab治疗可以有效缩短症状持续时间,并且在治疗5天后,能够观察到患者体内病毒载量显著降低。
就在同一天,中国国家药品监督管理局(NMPA)根据《药品管理法》的相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞新冠病毒药物奈玛特韦片/利托那韦片组合包装(Paxlovid)进口注册。
该药品为口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,比如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。去年12月22日,FDA批准Paxlovid的紧急使用授权,根据EPIC-HR研究,该药可以将住院或死亡风险降低89%。
2月11日,开拓药业宣布其普克鲁胺治疗轻中症新冠患者的全球多中三期临床试验已经在深圳市第三人民医院完成中国首例受试者入组及给药(图3)。普克鲁胺是一款雄激素受体拮抗剂和降解剂,对新冠感染早期和中后期均有很好的治疗疗效。
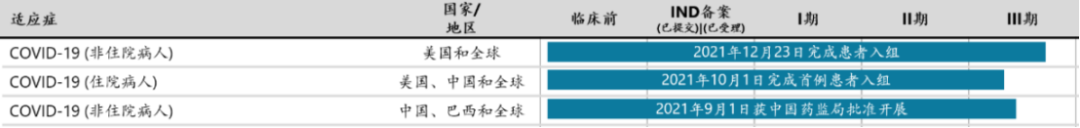
普克鲁胺研发进展(图源:开拓药业官网)
值得一提的是,2021年9月,在中国国际服务贸易交易会上,国药集团中国生物天坛生物带来了新冠特效药——静注COVID-19人免疫球蛋白(简称“新冠特免”),这是全球首款采用新冠灭活疫苗免疫后血浆制备的新冠治疗药物,是我国在新冠病毒治疗领域的一个突破性成果。2月15日,天坛生物发布公告,宣布静注COVID-19人免疫球蛋白已于去年10月获得阿联酋临床试验批件,目前已根据药品临床试验的要求完成临床伦理审查、临床用药清关、临床前入组等工作,将于近日在阿联酋开展Ⅱ期临床试验。
另外,在国内新冠抗体药物方面,由清华大学、深圳市第三人民医院和腾升华创联合开发的安巴韦单抗/罗米司韦单抗联合疗法进展较快(图4),该抗体联合疗法已在中国获批,并在美国向FDA提交了紧急使用授权申请。针对奥密克戎的体外嵌合病毒实验数据表明,安巴韦单抗/罗米司韦单抗联合疗法对奥密克戎和其他广受关注的新冠病毒变异毒株均保持中和活性,包括德尔塔和德尔塔+。

安巴韦单抗/罗米司韦单抗联合疗法研发进展(图源:腾盛博药官网)
目前,腾盛博药的安巴韦单抗/罗米司韦单抗联合疗法的紧急使用授权申请正在审核当中,这一联合疗法的紧急使用授权申请基于国际三期临床结果。研究结果显示,安巴韦单抗/罗米司韦单抗联合疗法能够使临床进展高风险的新冠门诊患者住院和死亡风险降低80%,并且该抗体联合疗法的临床安全性显著优于安慰剂。

声明:
1、凡本网注明“来源:2021广州国际检验医学暨体外诊断试剂博览会”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非2021广州国际检验医学暨体外诊断试剂博览会)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。

